
La química orgánica es la disciplina científica que estudia la estructura,
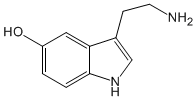 Serotoninapropiedades, síntesis y reactividad de compuestos químicos formados principalmente por carbono e hidrógeno, los cuales pueden contener otros elementos, generalmente en pequeña cantidad como oxígeno, azufre, nitrógeno, halógenos, fósforo, silicio.
Serotoninapropiedades, síntesis y reactividad de compuestos químicos formados principalmente por carbono e hidrógeno, los cuales pueden contener otros elementos, generalmente en pequeña cantidad como oxígeno, azufre, nitrógeno, halógenos, fósforo, silicio.
ELEMENTOS QUE CONSTITUYEN LA QUIMICA ORGANICA:
1-CARBONO:
Elemento químico de número atómico 6, masa atómica 12,01 y símbolo C ; es un no metal sólido que es el componente fundamental de los compuestos orgánicos y tiene la propiedad de enlazarse con otros átomos de carbono y otras sustancias para formar un número casi infinito de compuestos; en la naturaleza se presenta en tres formas: diamante, grafito y carbono amorfo o carbón; en cada una de estas formas tiene muchas aplicaciones industriales
2-HIDRÓGENO:
Elemento químico de número atómico 1, masa atómica 1,007 y símbolo H ; es un gas incoloro, inodoro y muy reactivo que se halla en todos los componentes de la materia viva y en muchos minerales, siendo el elemento más abundante en el universo; se utiliza para soldaduras, en la síntesis de productos químicos, etc., y, por ser el gas menos pesado que existe, se ha usado para inflar globos y dirigibles, aunque arde fácilmente, por lo que se suele sustituir por helio
3-OXIGENO:
Elemento químico de numero atómico 8, masa atómica 15,99 y símbolo O ; es un gas incoloro e inodoro que se encuentra en el aire, en el agua, en los seres vivos y en la mayor parte de los compuestos orgánicos e inorgánicos; es esencial en la respiración y en la combustión, se usa en soldaduras y se administra a pacientes con problemas respiratorios o a personas que vuelan a altitudes elevadas.
4-AZUFRE:
Elemento químico, de número atómico 16, masa atómica 32,064 y símbolo S ; es un no metal de color amarillo pálido y olor desagradable, que se encuentra en la naturaleza tanto en forma libre como combinado con otros elementos;
5- NITRÓGENO:
Elemento químico de número atómico 7, masa atómica 14,007 y símbolo N ; es un gas incoloro, inodoro e inerte, compone cuatro quintos del volumen del aire de la atmósfera y se usa para sintetizar amoníaco y otros productos.
La Química Orgánica es importante porque gracias a la química orgánica existe todo lo que hoy podemos percibir y sentir, ya que todo los productos orgánicos están presentes en todos los aspectos de nuestra vida, como por ejemplo:
-La ropa que vestimos.
- Los jabones, shampoos, desodorantes.
- Medicinas, perfumes, utensilios de cocina.
- La comida, etc.
► Es importante porque nos permite conocimiento de todo lo que funciona en nuestro organismo y el conocimiento de hasta todo nuestro propio cuerpo como por ejemplo:
- La progesterona.
- El colesterol, etc.
► Es importante porque sino hubiese existido la química orgánica no hubiéramos obtendrído medicamentos ni medicinas artificiales, es que gracias a la química orgánica es que va avanzando con el tiempo la tecnología, tanto en la medicina para crear y descubrir nuevos medicamentos que puedan combatir las enfermedades mortales de hoy en día.
► Importante porque todos los compuestos responsables de la vida, son sustancias orgánicas.
► Importante porque el progreso de la Química Orgánica permite profundizar en el esclarecimiento de los procesos vitales.
► La industria química (fármacos, polímeros, pesticidas, herbicidas) juega un papel muy importante en la economía mundial e incide en muchos aspectos de nuestra vida diaria con sus productos.
PRINCIPALES FUENTES DE OBTENCIÓN DE LOS COMPUESTOS ORGÁNICOS
1. Petróleo
Es la primera fuente de compuestos orgánicos. Al destilarlo se pueden obtener compuestos como la gasolina, diesel, gas, aceites, lubricantes, alcohol y otros compuestos utilizados como materia prima en la síntesis de colorantes, polímeros, medicamentos, etc.
2. Carbón
Es la principal materia prima tradicional y la segunda fuente de estas sustancias. Las rocas sedimentarias presionan los materiales orgánicos impidiendo el acceso de aire, con lo cual se forman capas duras, negras brillantes, constituidas fundamentalmente por carbono, oxigeno, hidrógeno, nitrógeno y algo de azufre. Al destilar la hulla en ausencia de aire a temperaturas de 1000º C a 3000º C, se desprenden sustancias volátiles: gas y alquitrán de hulla, y como residuo se obtiene carbón coque. La hulla está constituida por una mezcla de unos 200 compuestos carbonados, los cuales se utilizan como materia prima en la industria.
5. Síntesis orgánica
La síntesis total de un compuesto orgánico requeriría partir de los elementos que lo componen. Sin embargo a partir de ellos se puede obtener compuestos orgánicos simples como la úrea, el metano, metanol, acetileno, ácido acético, etanol y así siguiendo se puede ir construyendo estructuras cada vez más complejas.
4. Residuos vegetales y animales
Por extracciones y transformaciones sencillas se obtienen muchos compuestos orgánicos. Mediante la fermentación de melazas y mostos se obtienen alcoholes, ácidos, entre otros, por destilación de la madera se obtiene ácido acético, acetona y alcohol metílico.
3. Organismos animales y vegetales
A partir de estos organismos se obtienen mediante diferentes procesos: vitaminas, hormonas y alcaloides.
6. Gas natural
El gas natural se halla en yacimientos aislados y, en ocasiones, junto al petróleo. De las mezclas de gases se suelen separar, por licuación, los hidrocarburos de tres carbonos en adelante, que son envasados a presión y empleados como combustible, como el propano o el butano.
Compuesto orgánico o molécula orgánica es un compuesto químico que contiene carbono, formando enlaces carbono-carbono y carbono-hidrógeno.
DIFERENCIAS ENTRE QUÍMICA ORGÁNICA Y QUÍMICA INORGÁNICA


Cuando el átomo de C se excita, uno de los electrones del orbital 2s pasa al orbital 2pz y se obtiene el estado excitado del átomo de C. Se produce entonces la hibridación del orbital 2s con los tres orbitales 2p (x, y z) formándose cuatro orbitales híbridos sp3 cada uno de los cuales tiene un 25% de carácter S y un 75% de carácter P.
Los cuatro orbitales híbridos sp3 contienen 1 electrón y pueden enlazarse a un átomo cada uno(4 en total) siendo por tanto el carbono tetravalente.
Por disponer de 4 electrones de valencia, los átomos de carbono pueden enlazarse entre sí formando cadenas de una gran variedad: lineales, ramificada, anillos..
TETRAVALENCIA DEL CARBONO

Carbono es tetravalente (tiene valencia 4) y por tanto se puede unir a otros carbonos y elementos (entre 4 carbonos formando un tetraedro de cuatro caras) para formar muchos compuestos (llamados orgánicos), más de un millón de productos llevan C, muchos sólo C e H (hidrocarburos), otros sólo C, H, O (alcoholes, aldehídos, cetonas, ácidos), otros con C, H, N (amidas, aminas, nitrilos) ...
El Carbono se encuentra también en el carbón (antracita, hulla, lignito, turba), y en el grafito con el que se hacen las minas de lápices (estructura laminar)
El Carbono se encuentra también en el carbón (antracita, hulla, lignito, turba), y en el grafito con el que se hacen las minas de lápices (estructura laminar)
ORBITALES MOLECULARES
En química cuántica, los orbitales moleculares son regiones del espacio que contienen la densidad electrónica definida por (funciones matemáticas) que describen el comportamiento ondulatorio que pueden tener los electrones en las moléculas.

HIBRIDACION DEL CARBONO
CADENAS CARBONADAS
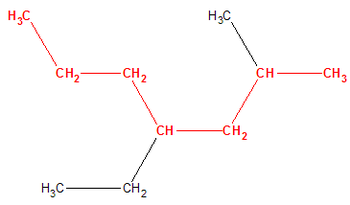
Una cadena carbonada es el esqueleto de prácticamente todos los compuestos orgánicos y está formada por un conjunto de varios átomos de carbono, unidos entre sí mediante enlaces covalentes carbono-carbono y a la que se unen o agregan otros átomos como hidrógeno, oxígeno o nitrógeno, formando variadas estructuras
CADENA RAMIFICADA
cadena cierta de átomos, generalmente de carbono, de la que salen varias cadenas laterales
CADENA CICLICA:
Son hidrocarburos de cadena cerrada. Los ciclos también pueden presentar insaturaciones. Los hidrocarburos cíclicos se nombran igual que los hidrocarburos (alcanos, alquenos o alquinos) del mismo número de átomos de carbono, pero anteponiendo el prefijo "ciclo-"
FORMULAS EMPLEADAS EN QUÍMICA ORGÁNICA
Una formula química es la representación por medio de símbolos de cada uno de los elementos que hacen parte de un compuesto. En orgánica se usan las siguientes formulas:
Formula Empírica: Indica la relación mas sencilla y la clase de átomos presentes en una molécula para determinar esta formula se requiere conocer el análisis porcentual del compuesto; indica la porción o numero relativo de cada elemento que se halla presente en la molécula. Algunos compuestos orgánicos presentan la misma formula empírica como el acetileno y el benceno cuya formula empírica es: CH
Formula Molecular: Presenta el numero total de átomos de cada elemento presentes en la molécula. Mediante el análisis se ha determinado que el acetileno presenta un peso molecular de 26 gr mientras que el benceno tiene un peso molecular de 78 gr, conociendo el peso molecular y la formula empírica, podemos deducir que la formula molecular de los anteriores compuestos es: C2 H2 para el acetileno y C6H6
Formula Estructural: Proporciona la información de cómo están unidos los átomos en la molécula. Para el caso del acetileno nos indica que los dos átomos de carbono están ubicados en el centro y unidos por un triple enlace y a cada lado de los carbonos se une un átomo de hidrogeno a través de enlace covalente simple, mientras que el benceno conserva los seis atomos de carbono unidos entre si formando un anillo, en donde se alternan los enlaces simples y dobles y a cada carbono esta unido un átomo de hidrogeno por medio de un enlace covalente simple.
Permite entender la distribución espacial de los átomos en una molécula, es muy importante en la química orgánica debido a que pueden existir dos compuestos con una misma formula molecular, pero con diferente formula estructural dando como resultado isómeros.
Para realizar esta formula se debe tener en cuenta:
Tipo y número de enlace
El c presenta siempre cuatro enlaces el hidrogeno y los halógenos uno, el oxígenos dos y el nitrógeno en los compuestos orgánicos tres
Los átomos de carbono pueden formar cadenas cerradas, abiertas, lineales o ramificadas
Los enlaces dobles y triples se muestran en la formula estructural condensada
Si existen grupos iguales en la formula condensada se agrupan
FORMULA ESTRUCTURAL DE ESQUELETO
En esta clase de formulas los enlaces carbono-carbono se muestran mediante estructuras en zigzag, los átomos diferentes de carbono y del hidrogeno se representan al igual que los dobles y tripes enlaces cada vértice presenta un átomo de carbono.
Hidrocarburos
Son los compuestos orgánicos más simples y pueden ser considerados como las sustancias principales de las que se derivan todos los demás compuestos orgánicos. Los hidrocarburos se clasifican en dos grupos principales, de cadena abierta y cíclicos. En los compuestos de cadena abierta que contienen más de un átomo de carbono, los átomos de carbono están unidos entre sí formando una cadena lineal que puede tener una o más ramificaciones. En los compuestos cíclicos, los átomos de carbono forman uno o más anillos cerrados. Los dos grupos principales se subdividen según su comportamiento químico en saturados e insaturados.
Alcanos Los hidrocarburos saturados de cadena abierta forman un grupo homólogo denominado alcanos o parafinas. Los primeros cuatro miembros del grupo son gases a presión y temperatura ambiente; los miembros intermedios son líquidos, y los miembros más pesados son semisólidos o sólidos.El petróleo contiene una gran variedad de hidrocarburos saturados, y los productos del petróleo como la gasolina, el aceite combustible, los aceites lubricantes y la parafina consisten principalmente en mezclas de estos hidrocarburos que varían de los líquidos más ligeros a los sólidos
Alquenos El grupo de los alquenos u olefinas está formado por hidrocarburos de cadena abierta en los que existe un doble enlace entre dos átomos de carbono. Al igual que los alcanos, los miembros más bajos son gases, los compuestos intermedios son líquidos y los más altos son sólidos. Los compuestos del grupo de los alquenos son más reactivos químicamente que los compuestos saturados.
Alquinos Los miembros del grupo de los alquinos contienen un triple enlace entre dos átomos de carbono de la molécula. Son muy activos químicamente y no se presentan libres en la naturaleza
Petróleo Es un líquido oleoso bituminoso de origen natural compuesto por diferentes sustancias orgánicas. Se encuentra en grandes cantidades bajo la superficie terrestre y se emplea como combustible y materia prima para la industria química. El petróleo y sus derivados se emplean para fabricar medicinas, fertilizantes, productos alimenticios, objetos de plástico, materiales de construcción, pinturas o textiles y para generar electricidad
Características Todos los tipos de petróleo se componen de hidrocarburos, aunque también suelen contener unos pocos compuestos de azufre y de oxígeno. El petróleo contiene elementos gaseosos, líquidos y sólidos. La consistencia varía desde un líquido tan poco viscoso como la gasolina hasta un líquido tan espeso que apenas fluye.Existen categorías de petróleos crudos los de tipo parafínico, los de tipo asfáltico y los de base mixta Formación El petróleo se forma bajo la superficie terrestre por la descomposición de organismos marinos. Los restos de animales minúsculos que viven en el mar se mezclan con las arenas y limos que caen al fondo en las cuencas marinas tranquilas. Estos depósitos, ricos en materiales orgánicos, se convierten en rocas generadoras de crudo. El proceso comenzó hace muchos millones de años, cuando surgieron los organismos vivos en grandes cantidades, y continúa hasta el presente. Los sedimentos se van haciendo más espesos y se hunden en el suelo marino bajo su propio peso. A medida que van acumulándose depósitos adicionales, la presión sobre los situados más abajo se multiplica por varios miles, y la temperatura aumenta en varios cientos de grados. El cieno y la arena se endurecen y se convierten en esquistos y arenisca; los carbonatos precipitados y los restos de caparazones se convierten en caliza, y los tejidos blandos de los organismos muertos se transforman en petróleo y gas natural.
Una vez formado el petróleo, éste fluye hacia arriba a través de la corteza terrestre porque su densidad es menor que la de las salmueras que saturan los intersticios de los esquistos, arenas y rocas de carbonato que constituyen dicha corteza. El petróleo y el gas natural ascienden a través de los poros microscópicos de los sedimentos situados por encima. Con frecuencia acaban encontrando un esquisto impermeable o una capa de roca densa: el petróleo queda atrapado, formando un depósito. Sin embargo, una parte significativa del petróleo no se topa con rocas impermeables sino que brota en la superficie terrestre o en el fondo del océano. Entre los depósitos superficiales también figuran los lagos bituminosos y las filtraciones de gas natural.
Prospección Para encontrar petróleo bajo tierra, los geólogos deben buscar una cuenca sedimentaria con esquistos ricos en materia orgánica que lleven enterrados el suficiente tiempo para que se haya formado petróleo (desde unas decenas de millones de años hasta 100 millones de años). Además, el petróleo tiene que haber ascendido hasta depósitos porosos capaces de contener grandes cantidades de líquido. La existencia de petróleo crudo en la corteza terrestre se ve limitada por estas condiciones, que deben cumplirse. Sin embargo, los geólogos y geofísicos especializados en petróleo disponen de numerosos medios para identificar zonas propicias para la perforación. Por ejemplo, la confección de mapas de superficie de los afloramientos de lechos sedimentarios permite interpretar las características geológicas del subsuelo, y esta información puede verse complementada por datos obtenidos perforando la corteza y extrayendo testigos o muestras de las capas rocosas. Por otra parte, las técnicas de prospección sísmica —que estudian de forma cada vez más precisa la reflexión y refracción de las ondas de sonido propagadas a través de la Tierra— revelan detalles de la estructura e interrelación de las distintas capas subterráneas. Pero, en último término, la única forma de demostrar la existencia de petróleo en el subsuelo es perforando un pozo. De hecho, casi todas las zonas petroleras del mundo fueron identificadas en un principio por la presencia de filtraciones superficiales, y la mayoría de los yacimientos fueron descubiertos por prospectores particulares que se basaban más en la intuición que en la ciencia.
Un campo petrolero puede incluir más de un yacimiento, es decir, más de una única acumulación continua y delimitada de petróleo. De hecho, puede haber varios depósitos apilados uno encima de otro, aislados por capas intermedias de esquistos y rocas impermeables. El tamaño de esos depósitos varía desde unas pocas decenas de hectáreas hasta decenas de kilómetros cuadrados, y su espesor va desde unos pocos metros hasta varios cientos o incluso más. La mayoría del petróleo descubierto y explotado en el mundo se encuentra en unos pocos yacimientos grandes.
Producción primaria La mayoría de los pozos petroleros se perforan con el método rotatorio. En este tipo de perforación rotatoria, una torre sostiene la cadena de perforación, formada por una serie de tubos acoplados. La cadena se hace girar uniéndola al banco giratorio situado en el suelo de la torre. La broca de perforación situada al final de la cadena suele estar formada por tres ruedas cónicas con dientes de acero endurecido. La roca se lleva a la superficie por un sistema continuo de fluido circulante impulsado por una bomba.
El crudo atrapado en un yacimiento se encuentra bajo presión; si no estuviera atrapado por rocas impermeables habría seguido ascendiendo debido a su flotabilidad hasta brotar en la superficie terrestre. Por ello, cuando se perfora un pozo que llega hasta una acumulación de petróleo a presión, el petróleo se expande hacia la zona de baja presión creada por el pozo en comunicación con la superficie terrestre. Sin embargo, a medida que el pozo se llena de líquido aparece una presión contraria sobre el depósito, y pronto se detendría el flujo de líquido adicional hacia el pozo si no se dieran otras circunstancias. La mayoría de los petróleos contienen una cantidad significativa de gas natural en solución, que se mantiene disuelto debido a las altas presiones del depósito. Cuando el petróleo pasa a la zona de baja presión del pozo, el gas deja de estar disuelto y empieza a expandirse. Esta expansión, junto con la dilución de la columna de petróleo por el gas, menos denso, hace que el petróleo aflore a la superficie.
A medida que se continúa retirando líquido del yacimiento, la presión del mismo va disminuyendo poco a poco, así como la cantidad de gas disuelto. Esto hace que la velocidad de flujo de líquido hacia el pozo se haga menor y se libere menos gas. Cuando el petróleo ya no llega a la superficie se hace necesario instalar una bomba en el pozo para continuar extrayendo el crudo.
Finalmente, la velocidad de flujo del petróleo se hace tan pequeña, y el coste de elevarlo hacia la superficie aumenta tanto, que el coste de funcionamiento del pozo es mayor que los ingresos que pueden obtenerse por la venta del crudo (una vez descontados los gastos de explotación, impuestos, seguros y rendimientos del capital). Esto significa que se ha alcanzado el límite económico del pozo, por lo que se abandona su explotación.
Recuperación mejorada de petróleo En el apartado anterior se ha descrito el ciclo de producción primaria por expansión del gas disuelto, sin añadir ninguna energía al yacimiento salvo la requerida para elevar el líquido en los pozos de producción. Sin embargo, cuando la producción primaria se acerca a su límite económico es posible que sólo se haya extraído un pequeño porcentaje del crudo almacenado, que en ningún caso supera el 25%. Por ello, la industria petrolera ha desarrollado sistemas para complementar esta producción primaria que utiliza fundamentalmente la energía natural del yacimiento. Los sistemas complementarios, conocidos como tecnología de recuperación mejorada de petróleo, pueden aumentar la recuperación de crudo, pero sólo con el coste adicional de suministrar energía externa al depósito. Con estos métodos se ha aumentado la recuperación de crudo hasta alcanzar una media global del 33% del petróleo presente. En la actualidad se emplean dos sistemas complementarios: la inyección de agua y la inyección de vapor.
Inyección de agua En un campo petrolero explotado en su totalidad, los pozos pueden perforarse a una distancia de entre 50 y 500 metros, según la naturaleza del yacimiento. Si se bombea agua en uno de cada dos pozos, puede mantenerse o incluso incrementarse la presión del yacimiento en su conjunto. Con ello también puede aumentarse el ritmo de producción de crudo; además, el agua desplaza físicamente al petróleo, por lo que aumenta la eficiencia de recuperación. En algunos depósitos con un alto grado de uniformidad y un bajo contenido en arcilla o barro, la inundación con agua puede aumentar la eficiencia de recuperación hasta alcanzar el 60% o más del petróleo existente. La inyección de agua se introdujo por primera vez en los campos petroleros de Pensilvania a finales del siglo XIX, de forma más o menos accidental y desde entonces se ha extendido por todo el mundo.
Inyección de vapor La inyección de vapor se emplea en depósitos que contienen petróleos muy viscosos. El vapor no sólo desplaza el petróleo, sino que también reduce mucho la viscosidad (al aumentar la temperatura del yacimiento), con lo que el crudo fluye más deprisa a una presión dada. Este sistema se ha utilizado mucho en California, Estados Unidos, y Zulia, Venezuela, donde existen grandes depósitos de petróleo viscoso. También se están realizando experimentos para intentar demostrar la utilidad de esta tecnología para recuperar las grandes acumulaciones de petróleo viscoso (bitumen) que existen a lo largo del río Athabasca, en la zona centro-septentrional de Alberta, en Canadá, y del río Orinoco, en el este de Venezuela. Si estas pruebas tienen éxito, la era del predominio del petróleo podría extenderse varias décadas.
Perforación submarina Otro método para aumentar la producción de los campos petroleros —y uno de los logros más impresionantes de la ingeniería en las últimas décadas— es la construcción y empleo de equipos de perforación sobre el mar. Estos equipos de perforación se instalan, manejan y mantienen en una plataforma situada lejos de la costa, en aguas de una profundidad de hasta varios cientos de metros. La plataforma puede ser flotante o descansar sobre pilotes anclados en el fondo marino, y resiste a las olas, el viento y —en las regiones árticas— los hielos.
Al igual que en los equipos tradicionales, la torre es en esencia un elemento para suspender y hacer girar el tubo de perforación, en cuyo extremo va situada la broca; a medida que ésta va penetrando en la corteza terrestre se van añadiendo tramos adicionales de tubo a la cadena de perforación. La fuerza necesaria para penetrar en el suelo procede del propio peso del tubo de perforación. Para facilitar la eliminación de la roca perforada se hace circular constantemente lodo a través del tubo de perforación, que sale por toberas situadas en la broca y sube a la superficie a través del espacio situado entre el tubo y el pozo (el diámetro de la broca es algo mayor que el del tubo). Con este método se han perforado con éxito pozos con una profundidad de más de 6,4 km desde la superficie del mar. La perforación submarina ha llevado a la explotación de una importante reserva adicional de petróleo.Refinado Una vez extraído el crudo, se trata con productos químicos y calor para eliminar el agua y los elementos sólidos y se separa el gas natural. A continuación se almacena el petróleo en tanques desde donde se transporta a una refinería en camiones, por tren, en barco o a través de un oleoducto. Todos los campos petroleros importantes están conectados a grandes oleoductos.
Destilación básica La herramienta básica de refinado es la unidad de destilación. El petróleo crudo empieza a vaporizarse a una temperatura algo menor que la necesaria para hervir el agua. Los hidrocarburos con menor masa molecular son los que se vaporizan a temperaturas más bajas, y a medida que aumenta la temperatura se van evaporando las moléculas más grandes. El primer material destilado a partir del crudo es la fracción de gasolina, seguida por la nafta y finalmente el queroseno. En las antiguas destilerías, el residuo que quedaba en la caldera se trataba con ácido sulfúrico y a continuación se destilaba con vapor de agua. Las zonas superiores del aparato de destilación proporcionaban lubricantes y aceites pesados, mientras que las zonas inferiores suministraban ceras y asfalto.
craqueo
Existen otros dos procesos básicos, la alquilación y el craqueo catalítico, que aumentaron adicionalmente la gasolina producida a partir de un barril de crudo. En la alquilación, las moléculas pequeñas producidas por craqueo térmico se recombinan en presencia de un catalizador. Esto produce moléculas ramificadas en la zona de ebullición de la gasolina con mejores propiedades (por ejemplo, mayores índices de octano) como combustible de motores de alta potencia, como los empleados en los aviones comerciales actuales.
Esto permite la producción de muchos hidrocarburos diferentes que luego pueden recombinarse mediante alquilación, isomerización o reformación catalítica para fabricar productos químicos y combustibles de elevado octanaje para motores especializados. La fabricación de estos productos ha dado origen a la gigantesca industria petroquímica, que produce alcoholes, detergentes, caucho sintético, glicerina, fertilizantes, azufre, disolventes y materias primas para fabricar medicinas, nylon, plásticos, pinturas, poliésteres, aditivos y complementos alimenticios, explosivos, tintes y materiales aislantes.
La contaminación con plaguicidas, los derrames de petróleo en el mar, los peligros de la radiación nuclear y los incendios forestales amenazan a los ecosistemas de la Tierra. Es esencial para la defensa de la vida en el planeta que se difundan y analicen los errores que han llevado a situaciones de grave daño ecológico.
Los derrames de petróleo Una de las mayores causas de la contaminación oceánica son los derrames de petróleo. El 46% del petróleo y sus derivados industriales que se vierten en el mar son residuos que vuelcan las ciudades costeras. El mar es empleado como un muy accesible y barato depósito de sustancias contaminantes, y la situación no cambiará mientras no existan controles estrictos, con severas sanciones para los infractores.
El 13% de los derrames se debe a accidentes que sufren los grandes barcos contenedores de petróleo, que por negligencia de las autoridades y desinterés de las empresas petroleras transportan el combustible en condiciones inadecuadas. En los últimos años, algunos de los más espectaculares accidentes fueron el del buque-tanque Valdés de la Exon, ocurrido frente a las costas de Alaska el 24 de marzo de 1989, y el del petrolero Mar Egeo, el 3 de diciembre de 1992, frente a la entrada del puerto de La Coruña, en España. Otro 32% de los derrames proviene del lavado de los tanques de los grandes buques que transportan este combustible.
Tanto los derrames de petróleo como los incendios forestales afectan gravemente las cadenas tróficas de los ecosistemas.
Los derrames ocasionan gran mortandad de aves acuáticas, peces y otros seres vivos de los océanos. Esto altera el equilibrio del ecosistema y modifica la cadena trófica. En las zonas afectadas, se vuelven imposibles la pesca, la navegación y el aprovechamiento de las playas con fines recreativos.
En los incendios forestales los árboles no son los únicos perjudicados: muchos animales quedan atrapados en el humo, mientras que otros migran.

GRUPO FUNCIONAL Y FUNCIÓN QUIMICA
Una función química es un conjunto de compuestos que tienen propiedades muy parecidas en virtud a que sus moléculas contienen uno o más átomos iguales (grupos funcional). Se considera como grupo funcional a un átomo o grupo de átomos que son los responsables del carácter químico de la molécula a la que pertenecen.

REACCIONES EN QUIMICA ORGANICA
Las reacciones orgánicas son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones orgánicas
Mecanismos de ruptura de enlace
Si se examina cualquier reacción orgánica se observa que se rompen enlaces en las sustancias reaccionantes y se forman nuevos enlaces en los productos.
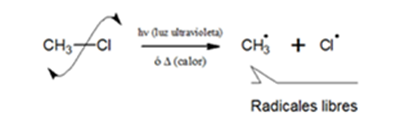
El rompimiento de enlaces puede ser simétrico, llamado también homolítico y asimétrico o heterolítico. El primero origina especies neutras con electrones desapareados, llamados radicales Libres y el segundo produceespecies iónicas.
Ruptura homolítica: en este caso,cada especie conserva el electrón que inicialmente aporto para formar el enlace. a cada una de las especies formadas se le denomina radicales libres,que son partículas muy inestables, energéticas y eléctricamente neutras. Para que este rompimiento se de es necesario la presencia de luz ultravioleta (hv) o calor.
- Reacciones de sustitución. Un átomo o grupo de átomos es reemplazado por otra especie.
- Reacciones de eliminación. Implica la extracción de un par de átomos o grupos de átomos de carbonos adyacentes, dando como resultado un enlace múltiple (doble o triple). También, se pueden eliminar dos átomos de los extremos de una cadena lineal para obtener cadenas cíclicas.
- Reacciones de adición. Se adicionan átomos o grupos de átomos, a los carbonos adyacentes de un enlace múltiple.



No hay comentarios:
Publicar un comentario